Nachwuchsmolekularbiologen
Praktikum für Nachwuchsmolekularbiologen am 25.09.2023
Drei Schülerinnen und ein Schüler aus dem Biologie-Leistungskurs der K2 hatten am 25.09.2023 die Möglichkeit am Institut für Biochemie und Molekularbiologie, der Universität Freiburg an Praktika , die Universitätsniveau erreichen, teilzunehmen. Den Gymnasiastinnen und Gymnasiasten, die vor dem Abitur stehen, sollten hier auch die Möglichkeit haben, sich über Studienmöglichkeiten in den „Life Sciences“ zu informieren.
Da das Praktikum bereits um 9:30 Uhr startete, mussten wir schon gegen 7 Uhr mit dem Zug in Karlsruhe losfahren. Jeder Teilnehmende hatte einen eigenen Arbeitsplatz, an welchem man im Verlaufe des Tages die molekularbiologischen Verfahren selbst anwenden durfte. Das Seminar begann mit einer theoretischen Einführung in das zu untersuchende Anwendungsbeispiel: Mit Verfahren wie der PCR (Künstliche Vervielfältigung von DNA-Sequenzen), dem Western Blot (Nachweis von bestimmten Proteinen in einer Probe mittels passenden Antikörpern) und einer Gelelektrophorese (Auftrennung von unterschiedlich langen DNA-Fragmenten der Länge nach, um mit dem entstehenden Bandenmuster auf Krankheitsbilder / Verwandtschaften zu schließen) sollten wir DNA-Sequenzen analysieren und nach Mutationen in bestimmten Genen Ausschau halten, die bei dem Träger der DNA die sogenannte Creutzfeldt-Jakob-Krankheit auslöst. Wenn Teile bestimmter Gene fehlen, so ist der Träger von der Krankheit betroffen. Diese Mutationsart, welche eine verkürzte DNA-Sequenz fordert, nennt man Deletion. Der Molekularbiologe Jan Brix erklärte uns grundlegende Prozesse wie die Vervielfältigung von DNA, Mutationen und die oben genannten molekularbiologischen Nachweisverfahren (PCR, Western Blot, Gelelektrophorese) anhand des Anwendungsbeispiels und ging dabei sehr anschaulich in die Tiefe. Zudem lag uns auch ein sehr ausführliches Skript mit ca. 30 Seiten vor, das all diese Theorie – aber auch Arbeitsanweisungen und Platz zum Protokollieren enthielt.
Zuallererst durften wir mit professionellen, automatischen Pipetten die DNA-Lösung aufbereiten, sodass man sie weitergehend analysieren konnte. Da ich nur das ungenaue Pipettieren mit Plastikpipetten aus dem Chemieunterricht kannte, war ich sehr erstaunt darüber, dass man die Pipetten im Labor auf den Milliliter genau programmiert und dann immer exakt diese Menge aufnimmt bzw. abgibt. Anschließend wurden alle Proben noch für einige Sekunden zentrifugiert, bevor sie für die PCR im Thermocycler-Gerät bereit waren. Logischerweise muss man die Proben immer möglichst gegenüber in die ringförmige Zentrifuge stellen, denn sonst würde diese kaputt gehen. Das ergibt zwar Sinn – vor allem wenn man bedenkt, dass das Gerät mit bis zu 500 000 Umdrehungen pro Minuten unvorstellbar schnell rotiert – aber bewusst war mir dies vorhin trotzdem nicht. Etwa 2 Stunden lang wurden die DNA-Fragmente im Thermocycler dann vervielfältigt und in der Zwischenzeit haben wir den Western Blot durchgeführt. Dafür haben wir Teststreifen, die Körperflüssigkeiten von Patienten enthielten, mittels passender Antikörper auf spezifische Proteine untersucht. Nach der Aufbereitung von diesen Proben (genau wie oben erklärt) wurden pro Probe eins von vier Antikörperseren hinzugegeben, dessen Antikörper sich passend an eine von vier zu untersuchenden Proteinarten anlagern kann. Damit sich die Antikörper gleichmäßig in der Probe verteilten, lagerten wir diese für etwa eine halbe Stunde auf dem sogenannten “Schüttler” – ein Gerät, dass sich langsam und gleichmäßig hin- und herbewegt und die Proben somit durchschüttelt. Witzig, welche einfachen Bewegungen im Labor von Maschinen über einen langen Zeitraum hinweg übernommen werden, oder?
Während die einen Proben geschüttelt wurden und die anderen noch eine Weile im Thermocycler verbleiben sollten, verbrachten wir unsere Mittagspause draußen. Wir konnten den schönen Park, welcher den Campus umschließt, bewundern und waren nach einem zehnminütigen Fußmarsch bereits in der Innenstadt, wo wir ein kleines Mittagessen und leckeren Spezialitätenkaffee genießen konnten. Als Studiernder in Freiburg hat man in der Zeit zwischen Vorlesungen oder praktischer Arbeit mit der Nähe zur Innenstadt und der Mensa auf dem Campus definitiv eine große Auswahl!
Nach der Mittagspause fügten wir unseren Protein-Antikörper-Proben farblose Vorstufenmoleküle hinzu, lagerten die Probe für eine kurze Zeit erneut auf dem “Schüttler” und kamen dann zur Auswertung des Western Blots. Durch den letzten Schüttelvorgang konnten sich die farblosen Vorstufenmoleküle an die Antikörper binden, welche an den Proteinen in der Probe gebunden sein sollten. Für die Auswertung wurde unsere Membran, welche ich vorhin als Streifen bezeichnet habe, zwischen zwei Filterpapiere gespannt und in einen Apparat gegeben, der die Umwandlung der farblosen Vorstufe in eine sichtbare Färbung erwirkte. Da unser Streifen an einer bestimmten Stelle, die für eins der vier Proteine charakteristisch ist, gefärbt war, war dieses Protein nachweislich vorhanden.
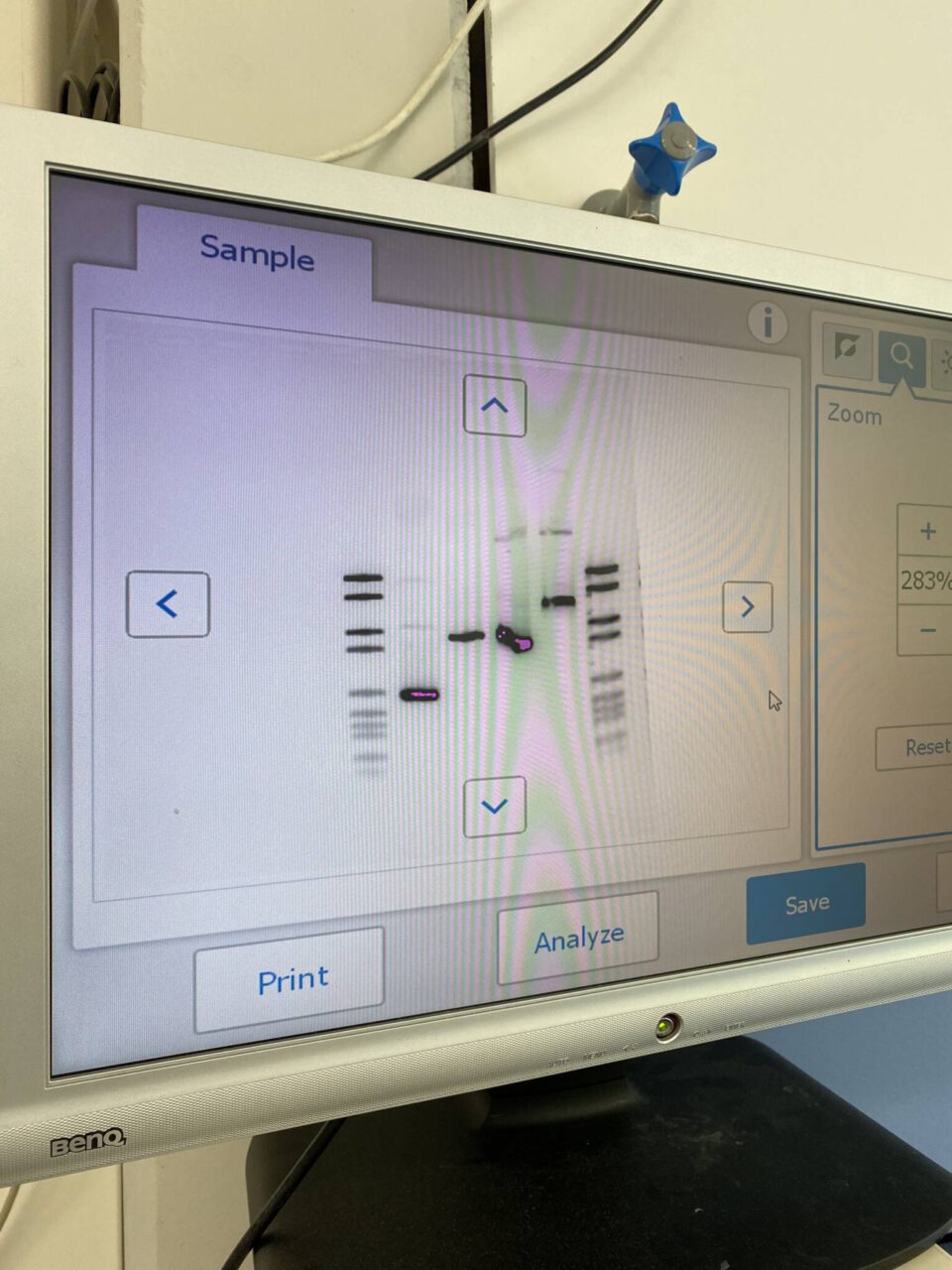
Zum Schluss werteten wir dann noch unsere vervielfältigen DNA-Proben aus, indem wir sie mittels einer Gelelektrophorese der Länge nach auftrennen und so ein charakteristisches Bandenmuster erhalten sollten. Mit krebserregenden Chemikalien (Schutzbrille und Handschuhe sollten getragen werden) stellten wir zuerst eine Gelplatte her. Anschließend legten wir in dieser Gelplatte kleine “Taschen” oder auch Löcher an, in die wir unsere Proben hineinpipettiert haben. Nachdem die Gelelektrophorese fertig konfiguriert war, legten wir eine Gleichspannung an. Da DNA leicht negativ geladen ist, wanderten unsere Proben vom Minuspol (Startpol) langsam zum Pluspol. Kürzere DNA-Fragmente können sich dabei schneller durch das Gelnetz bewegen als längere. Nach etwa einer Dreiviertel Stunde wurde die Spannung abgeschaltet und die Gelplatte in einem Gerät Fluoreszenz ausgesetzt, sodass die Banden (welche die einzelnen DNA-Fragmente darstellen) sichtbar wurden. Durch die Auswertung wurde klar, ob die Träger unserer Proben von der Creutzfeld-Jakob-Krankheit betroffen waren oder nicht. DNA-Fragmente, die aufgrund der Deletion bestimmter Genabschnitte kürzer als vergleichbare DNA-Sequenzen sind, wandern schneller durch das Gelnetz und sind im Bandenmuster weiter unten zu sehen. Da so eine tieferliegende Bande bei meiner Probe zu sehen war, konnte ich also darauf schließen, dass mein Patient erkrankt ist.
Abschließend möchte ich sagen, dass mir das Praktikum großen Spaß gemacht hat. Es war wirklich toll, die ganze Theorie, welche man im Unterricht gelernt und ständig bei Übungs- & Klausuraufgaben anwenden musste, auch mal tatsächlich in der echten Welt auszuprobieren. Außerdem haben wir vieles über das Studentenleben in Freiburg und molekularbiologische Studiengänge erfahren. Vielen Dank an das Veranstalter-Team aus Freiburg und vor allem an Frau Wolff, die mir – Josia und meinen Mitschülerinnen Clara, Tina und Sarah diesen aufschlussreichen Praktikumstag ermöglicht hat!